El ion formiato por ejemplo es totalmente simétrico. Las distancias C-O son idénticas y la carga negativa está repartida por igual entre ambos oxígenos.
Solapamiento de los orbitales p del fragmento O-C-O del ion formiato, mostrando la elevada deslocalización electrónica.
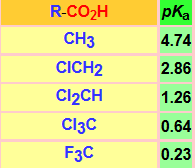
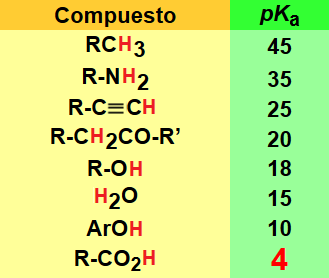
La acidez de un ácido carboxílico está modulada por la estructura del grupo R (Tabla).
Un grupo R dador de electrones, desestabilizará el anión carboxilato y hará que la fortaleza del ácido correspondiente sea menor. Este es el caso, por ejemplo, de los restos alquilo. Por el contrario, un grupo R electronegativo deslocalizará aún más la carga negativa del anión carboxilato, estabilizandolo, con lo que la fortaleza del ácido aumentará. Este es el caso, por ejemplo, de los restos halometilo, amonio y nitro.
El aumento del número de halógenos estabiliza de forma creciente el anión carboxilato y la acidez aumenta. El cambio de cloro por fluor, más electronegativo, aumenta la acidez.
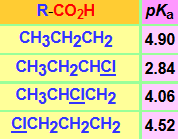
La presencia de un átomo de cloro en posición contigua al grupo carboxilato deslocaliza la carga negativa y aumenta la acidez. Pero esta deslocalización es muy sensible a la distancia.
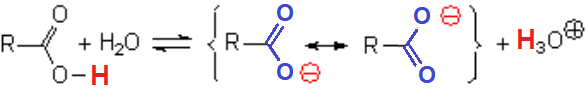 Las formas resonantes del anión carboxilato son totalmente equivalentes y la carga negativa se sitúa sobre los oxígenos, átomos muy electronegativos.
Las formas resonantes del anión carboxilato son totalmente equivalentes y la carga negativa se sitúa sobre los oxígenos, átomos muy electronegativos.