LA FORMA DE LAS SEÑALES
(ACOPLAMIENTO COMPLEJO)
A veces los protones vecinos a otro(s) no van "todos a una" y los desdoblamientos producidos NO obedecen la regla N+1, ni tampoco su intensidad se puede predecir mediante el triángulo de Tartaglia...
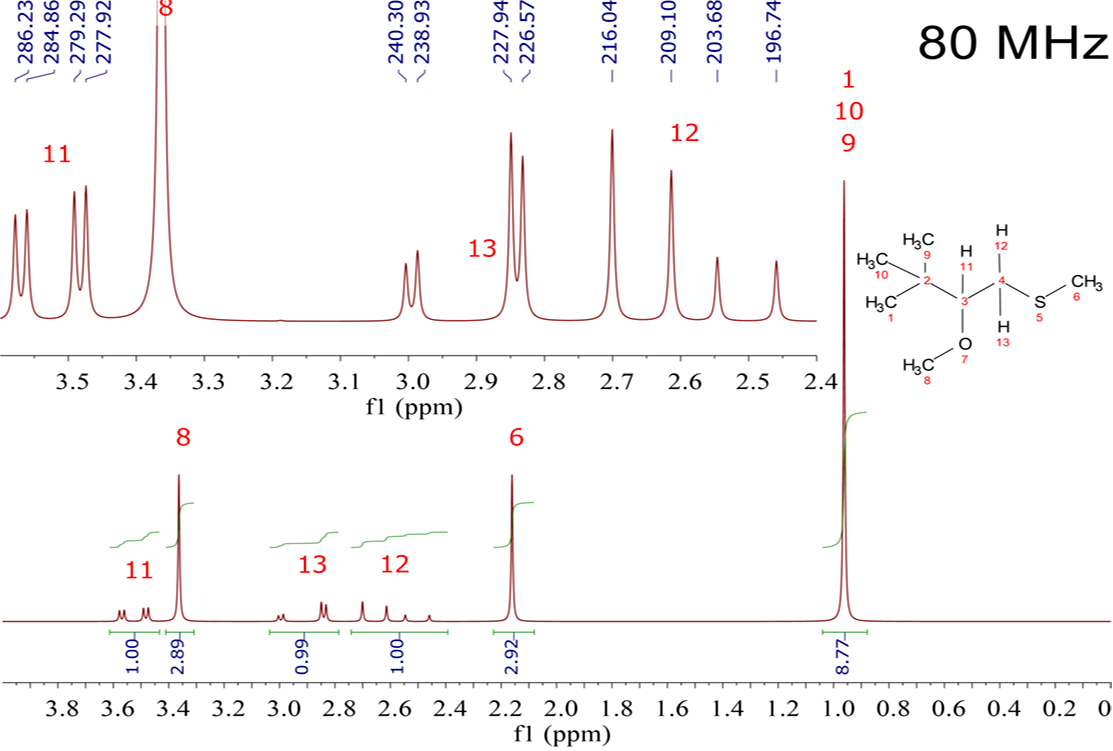
Mira este sencillo ejemplo. El espectro pertenece a la estructura indicada (CH3)3CH(OCH3)CH2SCH3. La señales están asignadas con los números en rojo.
Las señales más fáciles de entender son los “singletes” que tienen áreas (integrales) de 3:3:9 aproximadamente y que pertenecen a los grupos CH3.
Los tres grupos con numerales 1, 9 y 10 son equivalentes y resuenan juntos. No tienen ningún “vecino” y están unidos a un carbono [C(2)] que es poco electronegativo. De ahí su desplazamiento químico muy bajo (0.95 ppm).
Los grupos CH3 con numerales 6 y 8 son claramente NO equivalentes, ni entre sí ni en relación a los del grupo C(CH3)3. Por eso dan dos señales diferentes y, como tampoco tienen “vecinos”, son “singletes”.
El orden de electronegatividad es O > S > C. Por ello los hidrógenos del CH3O salen al mayor desplazamiento (3.35 ppm), después los del CH3S (2.15 ppm) y por último los del C(CH3)3 (0.95 ppm).
La dificultad de este espectro, como de tantos otros, es intentar entender por qué las señales de los hidrógenos 11, 12 y 13 salen como salen. Reflexiona.
El hidrógeno 11 tiene dos vecinos, 12 y 13 (N = 2). ¿Cómo debería salir? Como un simple triplete (N+1=¿2+1?).
Pero, ¿es un triplete? NO. Se observa lo que se denomina un “doble-doblete”.
Por otra parte los hidrógenos 12 y 13 parecen equivalentes y por tanto deberían de salir juntos en una única señal. Como sólo tienen de vecino al hidrógeno 11 (N = 1), ambos 12 y 13 deberían dar un doblete (N+1=¿1+1?). ¿Ocurre algo de esto? La respuesta es de nuevo NO. Ambos 12 y 13 aparecen como "dobles-dobletes" con intensidades peculiares en sus "patas" o líneas.
¿Podemos entenderlo? ¿Qué es lo que falla?
Nuestro error es considerar los hidrógenos 12 y 13 como equivalentes y NO lo son.
¿Por qué no son equivalentes? La clave está en el carbono numerado como 3. Tiene cuatro sustituyentes distintos. Es un “estereocentro” o centro generador de “asimetría”.
Los dos hidrógenos de un grupo CH2 son en general equivalentes por simetría.
Pero, si en la molécula existe un “estereocentro”, esa equivalencia deja de ser cierta porque ya no hay simetría. La presencia del “estereocentro” la rompe.
Por tanto, LOS DOS HIDRÓGENOS DE CUALQUIER GRUPO CH2 DE CUALQUIER MOLÉCULA QUE AL MENOS TENGA UN “estereocentro” dejan de ser equivalentes y PUEDEN RESONAR A DIFERENTE DESPLAZAMIENTO QUÍMICO, como sucede con los hidrógenos 12 y 13 de nuestra molécula.
Los hidrógenos 11, 12 y 13 se influencian entre sí pero de forma individual ya que no hay ninguna equivalencia entre ellos al estar rota una posible simetría por la presencia del “estereocentro”, es decir, del carbono 3 con cuatro sustituyentes diferentes.
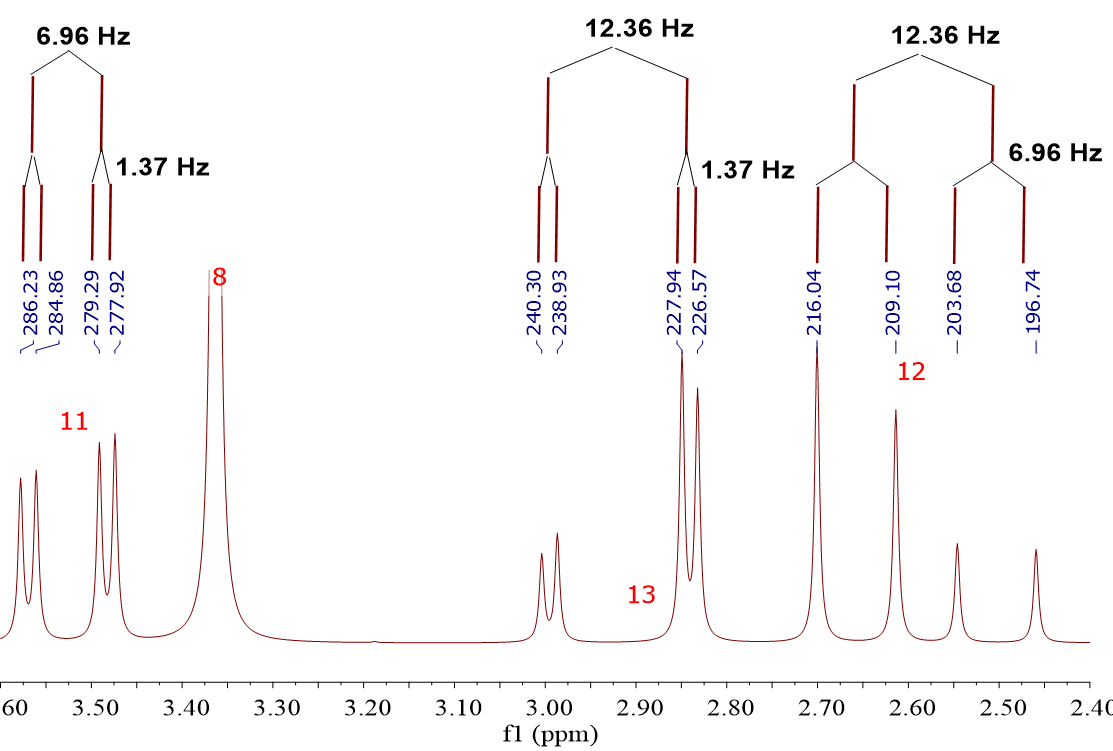
Si hubiera simetría, el hidrógeno 11 sería influído por 12 y 13 de la misma manera y se obtendría un triplete (regla del N+1). Sin embargo, al no existir simetría, 12 y 13 influencian a 11 de forma diferente y se da lugar a dos desdoblamientos distintos y a un “doble-doblete”.
Los desdoblamientos se miden en Hz. En este caso concreto son: J3(H11/H13) = 1.37 Hz
J3(H11/H12) = 6.96 Hz.
Como la influencia es recíproca, en los hidrógenos 12 y 13 deberemos encontrar estos mismos desdoblamientos, de 1.37 Hz (en H13) y de 6.96 Hz (en H12).
¿De donde viene el desdoblamiento de 12.36 Hz? Lo has adivinado: de la influencia que 12 y 13 ejercen entre sí, al no ser hidrógenos equivalentes por la existencia del “estereocentro”.
El acoplamiento entre 12 y 13 se produce a través de dos enlaces. Por ello se utiliza la notación J2(H12/H13) = 12.36 Hz.