FUNDAMENTO FÍSICO DEL DESPLAZAMIENTO QUÍMICO DE 1H
Los núcleos de 1H (o de 13C) dentro de una misma molécula, ¿“sufren” todos el mismo campo magnético?
La respuesta la conocemos aunque la pregunta está formulada de forma inesperada.
Puesto que los núcleos de 1H (o de 13C)dentro de una misma molécula NO “resuenan” todos a la misma frecuencia, la respuesta a esta pregunta debe ser NO:
LOS 1H (o 13C) DENTRO DE UNA MISMA MOLÉCULA RESUENAN A DIFERENTES FRECUENCIAS Y, POR TANTO, SUFREN CAMPOS MAGNÉTICOS DIFERENTES.
Si el campo magnético externo es fijo, ¿cuál es la razón de que los núcleos activos en RMN de una molécula no lo sufran todos de la misma manera?
La respuesta está en la densidad de electrones que circunda a los núcleos. ¿Poseen todos los 1H ó 13C de una molécula la misma densidad electrónica?
Si tienes unos mínimos conocimientos de Química Orgánica, sabes que de nuevo la respuesta es NO.
¿De qué depende que los núcleos tengan más o menos densidad electrónica a su alrededor?
De los otros átomos que les circundan y de la ELECTRONEGATIVIDAD de los mismos.
El concepto de la ELECTRONEGATIVIDAD es muy importante en Química y es la capacidad que tiene un átomo para atraer hacia sí los electrones del enlace que mantiene con otro átomo.
Volvamos a uno de nuestros ejemplos: la molécula CH3CHClCH3. El Cl es muy electronegativo porque tiene 17 protones en el núcleo, que atraen con fuerza a los electrones de su enlace C-Cl.
El grupo CH ve así muy disminuida su densidad electrónica.
Los 13C y los 1H de los grupos CH3, a dos y tres enlaces del Cl, al estar más distantes, sufren una menor disminución de su densidad electrónica.
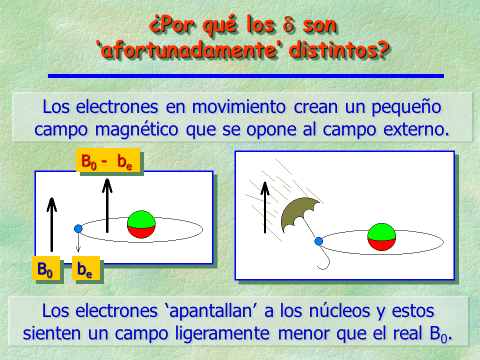
Los electrones son partículas cargadas que giran en torno al núcleo y por tanto, crean un campo magnético que se opone al campo magnético externo del equipo de RMN.
Cuanto menor es la densidad electrónica alrededor de un núcleo de 1H ó 13C, mayor será el campo externo que “sufre” y mayor será la frecuencia a la que “resuene”.
Por tanto, la densidad electrónica “apantalla” a los núcleos del campo magnético externo.
Los 1H y 13C, dependiendo del lugar que ocupen en la molécula, se encontrarán más o menos apantallados, apareciendo en consecuencia a diferentes “desplazamientos químicos”.
Gracias a este fenómeno del diferente “apantallamiento” electrónico de los núcleos es por lo que la RMN resulta extraordinariamente útil para la determinación de estructuras orgánicas.
Retornemos una última vez a nuestro ejemplo y vamos a hablar en términos típicos de un “experto” en RMN:
La molécula CH3CHClCH3 da dos señales en 1H-RMN, a 3.97 ppm y 1.55 ppm, que se asignan al grupo CH y los grupos CH3, respectivamente.
El protón del grupo CH aparece a un desplazamiento químico “más desapantallado” que los grupos CH3 por el efecto de la electronegatividad ("efecto inductivo aceptor de electrones") del átomo de Cl cercano.
En definitiva, los núcleos son los actores principales de “la película de la RMN” pero sus “vestimentas electrónicas” son las que les hacen “lucirse a izquierda o derecha del escenario”.
Una “vestimenta electrónica” más ligera significa un menor apantallamiento y un desplazamiento químico más alto (izquierda de la escala).
Una vestimenta electrónica más “invernal” lleva a los núcleos a un “mayor apantallamiento” y a un menor desplazamiento químico (derecha de la escala).
En general, la menor o mayor “vestimenta electrónica” de los núcleos de 1H depende de la mayor o menor proximidad, respectivamente, de átomos electronegativos o de la cantidad de éstos.
La serie CH4, CH3Cl, CH2Cl2 y CHCl3, que estudiamos en el apartado anterior, es una buena muestra de ello. Pero mira los dos espectros siguientes:
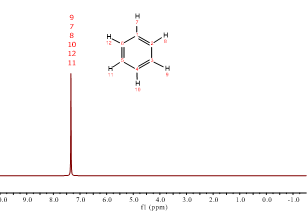
¿Por qué los hidrógenos del benceno resuenan prácticamente al mismo desplazamiento químico que los del cloroformo si no tiene átomos electronegativos? Es una buena pregunta.
Los electrones vuelven a ser los responsables, si bien ahora actúan en conjunto.
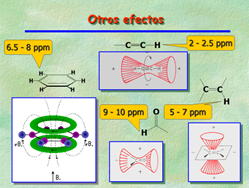
Si estudias lo que es un anillo de benceno y la propiedad de la “aromaticidad” verás que los electrones de los dobles enlaces pueden moverse libremente a lo largo del hexágono. Esa circulación de electrones crea un campo magnético local que refuerza al externo justo en la zona donde están los hidrógenos, que sufren entonces un campo magnético ligeramente superior y, como consecuencia, resuenan a frecuencias más altas.
Los enlaces múltiples tienen efectos de este tipo y los hidrógenos unidos a ellos aparecen a desplazamientos químicos especialmente altos, como en el caso del benceno, a pesar de no haber átomos electronegativos. El hidrógeno de los aldehídos sufre de los dos efectos: la electronegatividad del oxígeno que le “desnuda” de densidad electrónica y la circulación electrónica del doble enlace que crea un pequeño campo adicional que se superpone al campo externo.
En resumen, los hidrógenos de las moléculas están afectados en su desplazamiento químico por los efectos de electronegatividad de los átomos vecinos y por las “corrientes” electrónicas que se producen en los enlaces múltiples, que generalmente desapantallan los protones próximos, a excepción de los triples enlaces terminales, cuyo hidrógeno directamente unido al carbono que soporta el triple enlace, cae en la zona de apantallamiento.
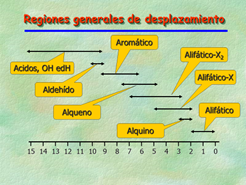
El esquema muestra un resumen de las zonas de desplazamiento químico para los diversos grupos funcionales. Puedes ver que el rango máximo de desplazamiento químico en 1H-RMN es de 15 ppm, siendo el habitual para hidrógenos unidos a carbonos con enlaces sencillos de 0-5 ppm y el de los dobles enlaces y anillos aromáticos como el benceno de 5-8 ppm.