LA INTENSIDAD DE LAS SEÑALES
(INTEGRAL)
El área de las señales o, lo que es lo mismo, su “integral”, responde al número de hidrógenos responsables de ellas. Mira los ejemplos siguientes. De ellos aprenderemos dos cosas respecto de las “integrales”:
Supón que no conoces las estructuras que corresponde a los espectros.
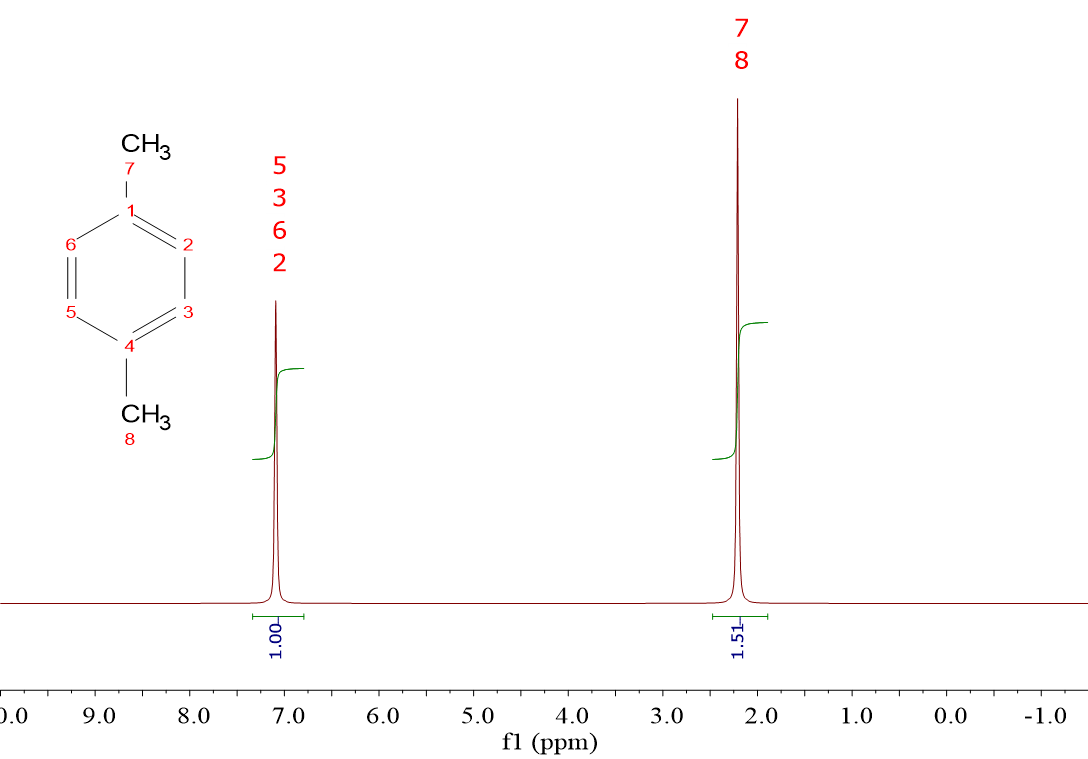
Por ejemplo, considera el espectro de la izquierda.
Integras y asignas la integral unidad a la señal más pequeña. ¿Crees que es razonable cómo integra la otra señal en proporción? ¿puede existir hidrógeno y medio?
Lo has adivinado. Lo razonable es multiplicar las integrales por números enteros hasta que se aproximen a hidrógenos “enteros”. Así que podemos multipicar por 2, o por 4, etc. con lo que tendremos una relación de integrales 2:3, 4:6, etc. de números enteros.
Pero fíjate ahora en la estructura. Por lo que explicamos antes, la señal a desplazamiento químico alto (7.1 ppm) debe pertenecer a los 1H directamente unidos al anillo, que son los que sufren el máximo “despantallamiento” por la corriente de electrones del anillo.
Son 4 y resuenan en una única señal porque son equivalentes o indistinguibles por simetría. La otra señal debe pertenecer a los grupos CH3, 6 hidrógenos en total, que también son entre sí equivalentes o indistinguibles por simetría. Por tanto, la proporción real de área que guardan las señales no es 2:3 sino 4:6, es decir, las áreas iniciales 1:1,5 ha habido que multiplicarlas por 4.
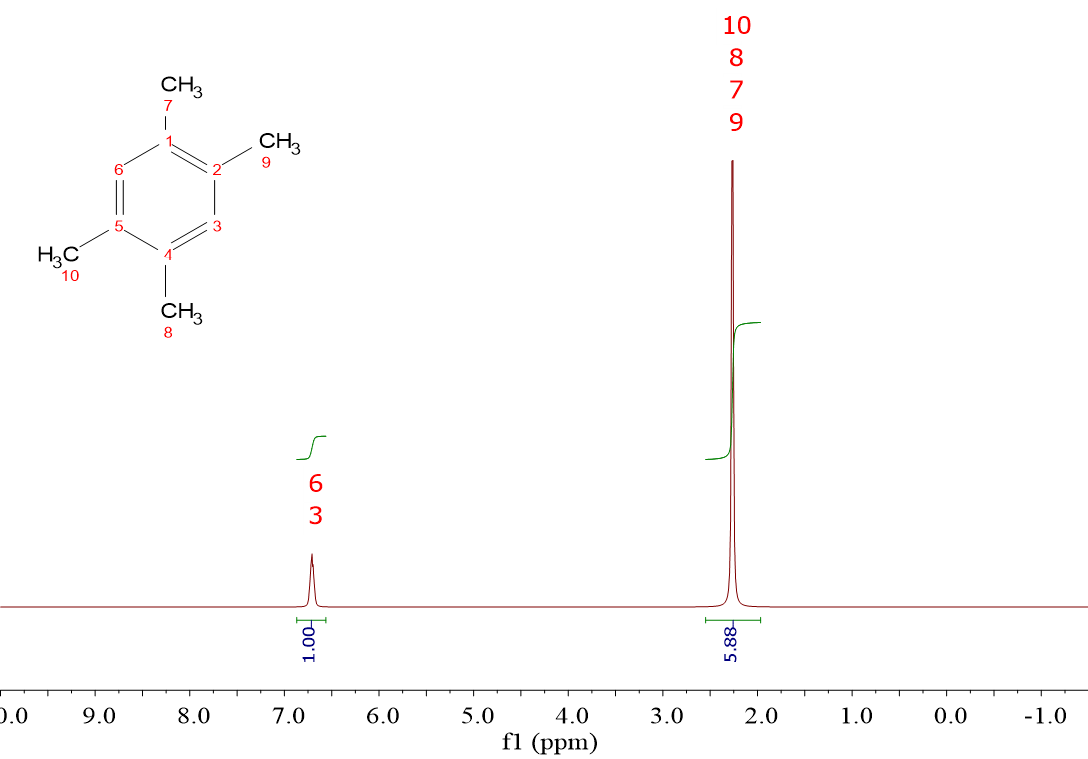
En el espectro de la derecha sucede algo semejante porque está claro que la relación de áreas inicial hay que multiplicarla por 2, a la vista de la estructura. Pero la señal de la derecha tiene entonces un área de 11.76, que no es un número entero.
Esto es otro detalle que debes aprender:
no esperes una precisión absoluta de la integral.
La integración de las señales es una operación gráfica que tiene un error intrínseco de al menos el 5%, que puede llegar incluso al 10%, dependiendo del “ruido” del espectro (ver más adelante) y de la proximidad y/o solapamiento entre las señales integradas.
Así que, resumiendo, la integración del espectro debe realizarse asignando la unidad al área más pequeña de todas las medidas y, si es necesario, se deben multiplicar las áreas por un número entero que haga que todas las áreas se acerquen a números enteros. Que lo hagan de una manera más o menos perfecta depende del error de la integración, que puede llegar a ser hasta del 10%, y no necesariamente en todas las señales por igual.
Mira estos nuevos ejemplos: más “trucos” para aprender.
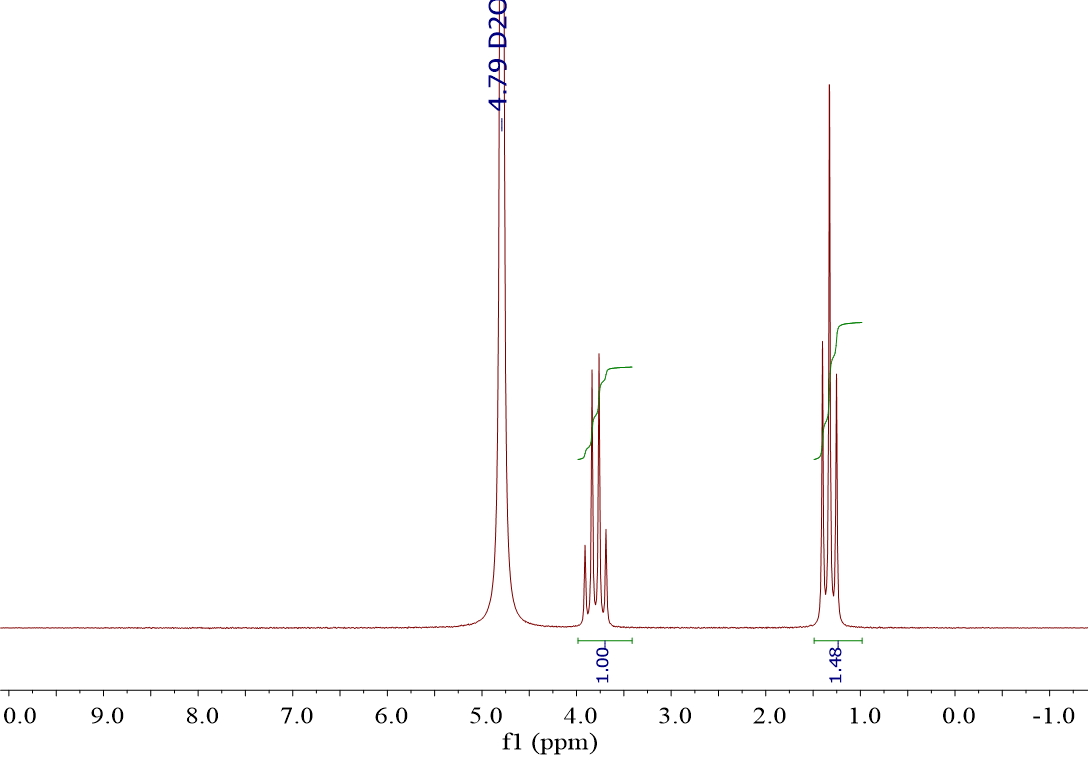
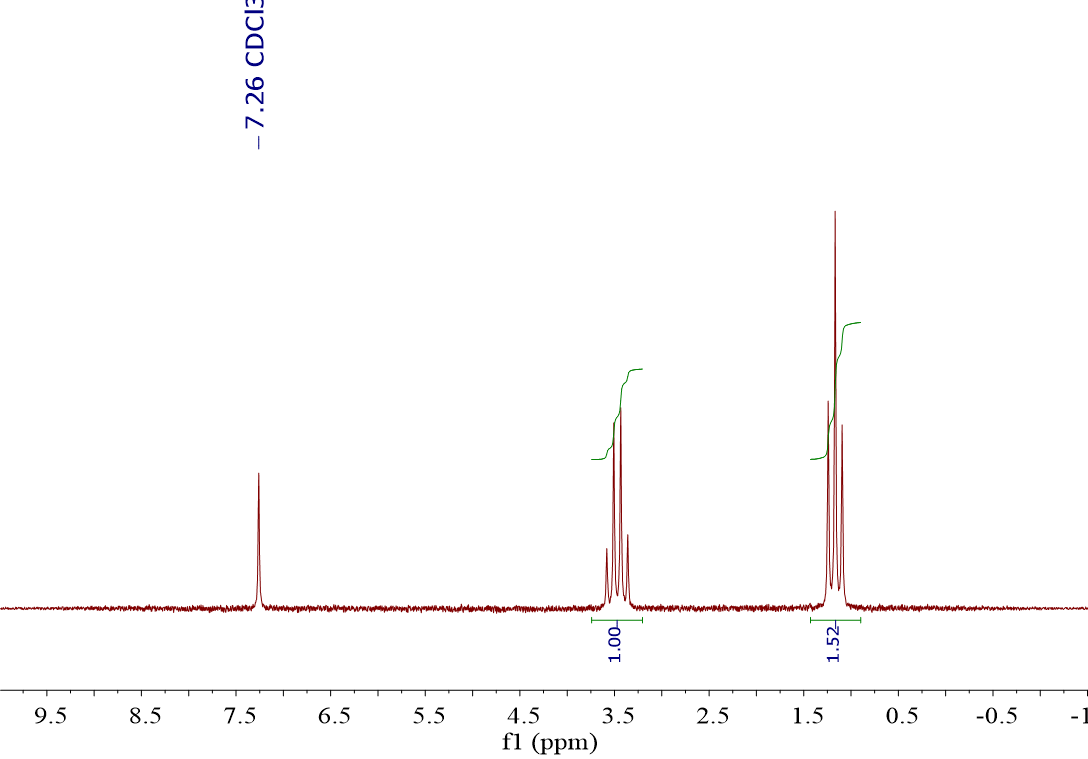
Dando un vistazo rápido los dos espectros parecen iguales. Hay una gran diferencia, que es el disolvente en que se ha disuelto la sustancia.
En este caso en D2O, es decir, “agua deuterada”.
En este en CDCl3, es decir, “cloroformo deuterado”.
Lo primero que hay que hacer al analizar un espectro de RMN es identificar las señales del disolvente que se ha utilizado para disolver la muestra. Las señales del disolvente no pertenecen al compuesto cuya estructura se investiga y, por tanto, no deben considerarse en su elucidación estructural.
Salvo en muy raras excepciones, NO TIENE SENTIDO INTEGRAR LA(S) SEÑAL(ES) DEL DISOLVENTE, porque no pertenece(n) al compuesto que estamos investigando.
En RMN se utilizan usualmente disolventes “deuterados”, es decir, que no tienen hidrógeno (1H) sino “deuterio” (2H), que es el isótopo de hidrógeno con masa atómica 2 (un protón más un neutrón).
EL DEUTERIO RESUENA A UNA FRECUENCIA MUY DIFERENTE AL HIDRÓGENO, porque el núcleo de 2H tiene una “constante giromagnética” muy diferente a la del 1H (ver el apartado anterior).
Por tanto, el disolvente deuterado no aparece en el espectro de 1H. Sin embargo, se obtiene una pequeña señal residual porque el disolvente deuterado, incluso el más caro y puro que se pueda encontrar, siempre tiene una pequeña cantidad de 1H, que lógicamente se ve en el espectro.
Excluídas las señales de los disolventes (4.79 ppm y 7.26 ppm para las señales residuales de H2O y CHCl3, respectivamente), los espectros son enormemente parecidos.
La forma de las señales es exactamente la misma (“cuartete” y “triplete”) y la relación de integrales es casi idéntica.
Sin embargo, los desplazamientos químicos son ligeramente diferentes. Mídelos (3.8 ppm y 1.3 ppm, izquierda; 3.5 ppm y 1.2 ppm). ¿Serán la misma sustancia? La verdad es que es muy difícil de decir con estos dos espectros nada más…
ETANOL
(CH3CH2OH).
DIETILÉTER (CH3CH2OCH2CH3).
Los desplazamientos químicos son ligeramente diferentes pero hay que tener en cuenta que, al haberse registrado los espectros en disolventes diferentes, incluso aunque hubiera sido de la misma sustancia, los desplazamientos químicos se pueden ver ligeramente afectados.
¿Cómo resolveríamos el problema? Aunque la RMN es una herramienta extraordinaria, a veces acudiendo a otra técnica, resolveríamos el problema muy fácilmente.
¿Qué se te ocurre hacer?
Efectivamente, un espectro IR de las sustancias puras, sin disolvente, nos daría la respuesta porque ambas tienen grupos funcionales muy diferentes. Mira la sección que dedicamos a otras espectroscopías. También nos daría la respuesta un espectro de masas, porque las masas de ambos compuestos son muy distintas...