Ya hemos vistos que, afortunadamente, los 1H's de una molécula dan señales que aperecen a
desplazamientos químicos diferentes dependiendo del lugar que ocupan en la molécula, es decir, de su TOPICIDAD.
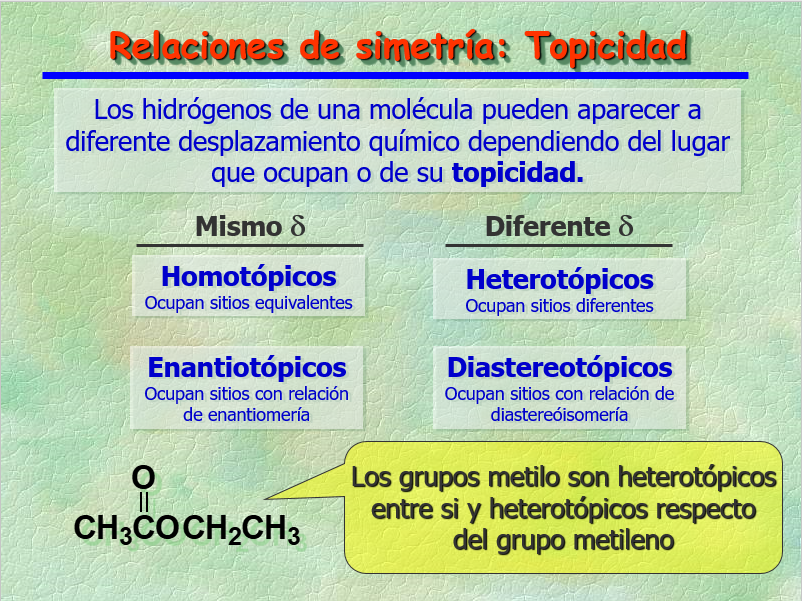
Los grupos de núcleos en una molécula pueden tener las TOPICIDADES que se indican.
Dependiendo de su TOPICIDAD, aparecerán obligatoriamente al mismo desplazamiento químico o podrán hacerlo a diferentes desplazamientos químicos.
Entre estos últimos, siempre puede ocurrir una coincidencia accidental.
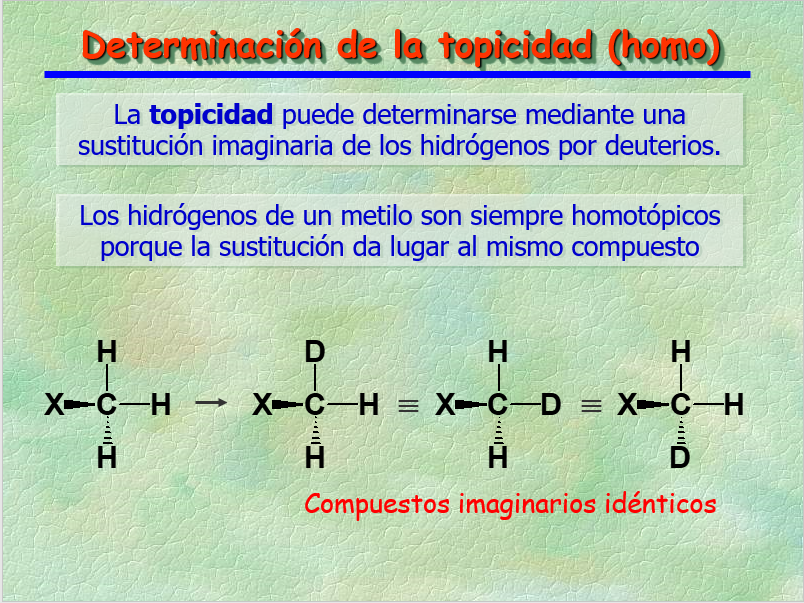
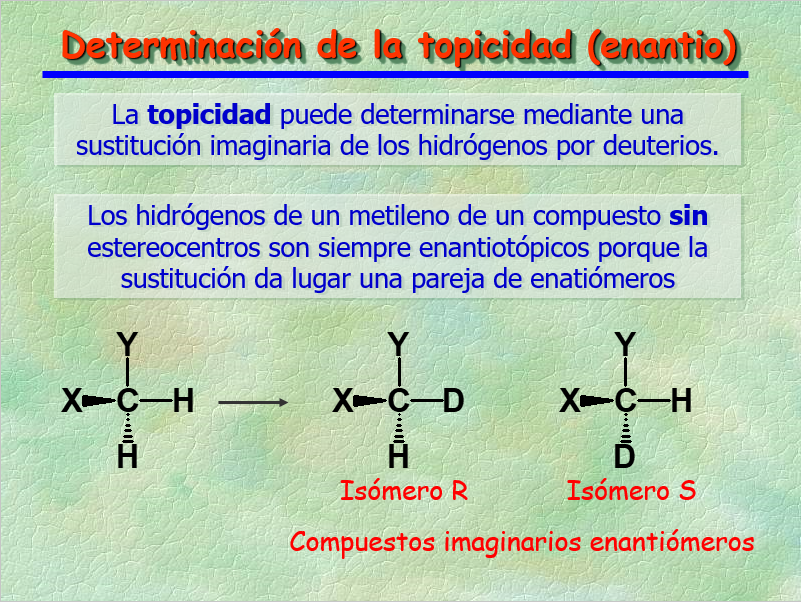
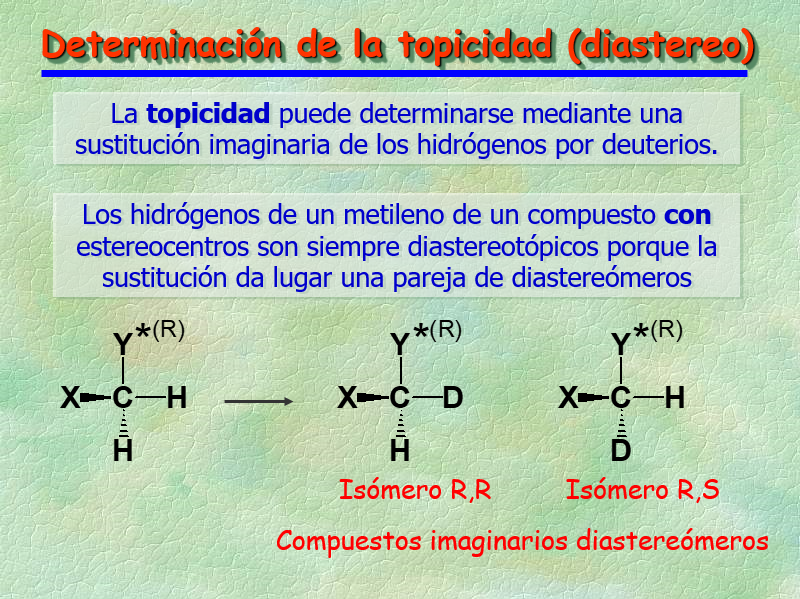
La TOPICIDAD se puede determinar mediante el "truco" de la sustitución isotópica imaginaria.
Los núcleos resultan HOMOTÓPICOS si la sustitución isotópica imaginaria da lugar al mismo compuesto.
Los núcleos HOMOTÓPICOS son ISÓCRONOS, es decir, resuenan al mismo desplamiento químico.
Los 1H's de un grupo CH2 de una molécula que NO posea estereocentros son siempre ENANTIOTÓPICOS , como lo demuestra la sustitución isotópica imaginaria que produce una pareja de enantiómeros.
Los núcleos ENANTIOTÓPICOS resuenan al mismo desplazamiento químico, es decir, son ISÓCRONOS.
Los 1H's de un grupo CH2 de un compuesto que posea al menos un estereocentro resultan DIASTEREOTÓPICOS porque la sustitución isotópica imaginaria rinde una pareja de diastereómeros.
Los núcleos DIASTEREOTÓPICOS pueden resonar a diferente desplazamiento químico, es decir, pueden no ser ISÓCRONOS.
En general, resuenan a diferente desplazamiento químico aunque no se puede excluir la coincidencia accidental.
En una molécula donde no existan estereocentros, ¿pueden existir 1H's diastereotópicos? La respuesta es SÍ.
Un excelente ejemplo es la glicerina HOCH2CH(OH)CH2OH.
Comprueba que la sustitución isotópica imaginaria de los 1H's de los CH2 dan lugar a la aparición de un estereocentro en el carbono central y por ello los 1H's de cada CH2 resultan distereotópicos entre sí.