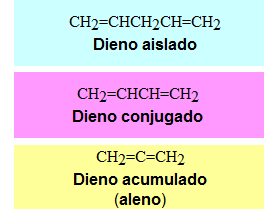
PROPIEDADES FÍSICAS Y DE ENLACE DE DIENOS
Los dienos aislados no tienen propiedades de enlace diferentes de los alquenos. Los dienos acumulados y conjugados sí tienen propiedades especiales.
Dienos Acumulados (Alenos)
Para explicar la estructura de un aleno, el carbono central de los dienos acumulados hemos de considerarlo en hibridación sp, NO sp2.
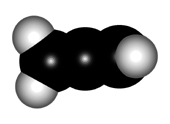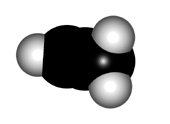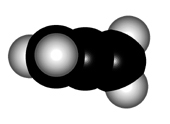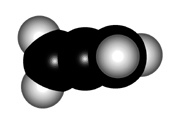 El mayor caracter "s" de los orbitales híbridos del carbono central ocasionan que la distancia C-C sea un poco más corta que en un alqueno.
El mayor caracter "s" de los orbitales híbridos del carbono central ocasionan que la distancia C-C sea un poco más corta que en un alqueno.
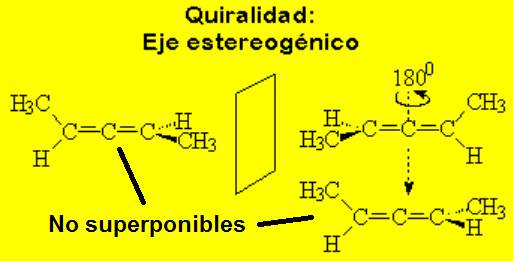 El 2,3-pentadieno tiene dos estructuras enantioméricas.
El 2,3-pentadieno tiene dos estructuras enantioméricas.
Los alenos pueden ser quirales.
Aunque los alenos no poseen ningún estereocentro, los que tienen dos sutituyentes distintos en los extremos tienen un eje quiral que ocasiona que objeto e imagen no sean superponibles.
Para determinar la configuración de un aleno se numeran los sustituyentes, primero los del carbono de delante y despues los de detrás, siguiendo las reglas de prelación habituales. Se dibuja un tetraedro tal y como se muestra en la figura, se sitúa el sustituyente de menor prelación hacia atrás y se observa el sentido de giro necesario para ir de 1 á 2 y á 3.
El enlace central de los dienos conjugados tienen un carácter doble parcial.
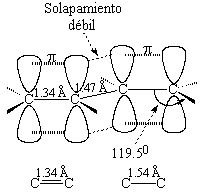 La longitud del enlace central es intermedia entre la de uno simple y uno doble.
La longitud del enlace central es intermedia entre la de uno simple y uno doble.
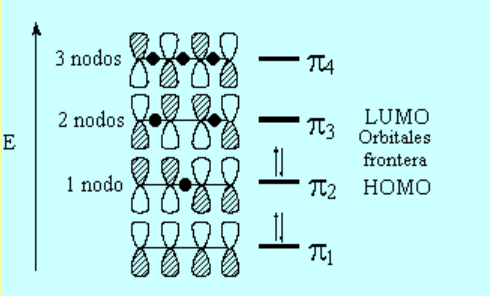 El solapamiento lateral de los cuatro orbitales atómicos "p"produce cuatro orbitales moleculares "pi". El orbital "pi1" deslocaliza la densidad electrónica a lo largo de los cuatro átomos implicados en un dieno conjugado. Sin embargo en el "pi2" no. Esto explica el carácter doble parcial del enlace central.
El solapamiento lateral de los cuatro orbitales atómicos "p"produce cuatro orbitales moleculares "pi". El orbital "pi1" deslocaliza la densidad electrónica a lo largo de los cuatro átomos implicados en un dieno conjugado. Sin embargo en el "pi2" no. Esto explica el carácter doble parcial del enlace central.
La pequeña contribución de las formas resonantes con separación de cargas también explican que el enlace central tenga un pequeño carácter doble.
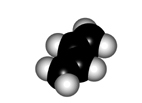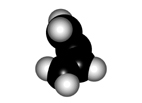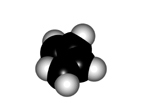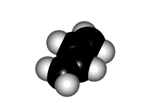
El giro del enlace central de un dieno conjugado tiene características diferentes a las de un alcano:
Para que los orbitales p solapen el sistema diénico tiene que ser plano. Se pueden tener dos conformaciones, denominadas s-trans (más estable) y s-cis, como consecuancia de la rotación del enlace central.
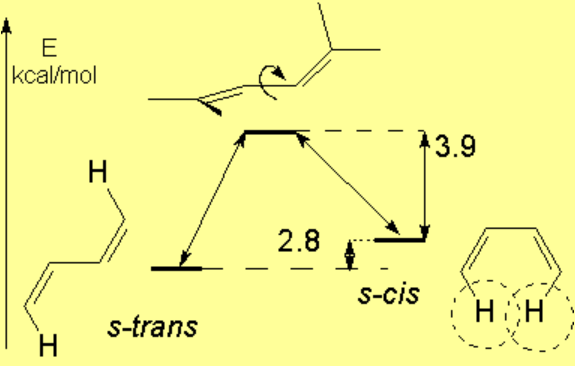 Este giro es más costoso (6.7 kcal/mol) que en un alcano debido a que en el ET, con los planos de los dobles enlaces a 90º, no es posible el solapamiento del orbital "pi1".
Este giro es más costoso (6.7 kcal/mol) que en un alcano debido a que en el ET, con los planos de los dobles enlaces a 90º, no es posible el solapamiento del orbital "pi1".
AZUL = Estado de transición
ROJO = impedimento estérico de la conformación s-cis
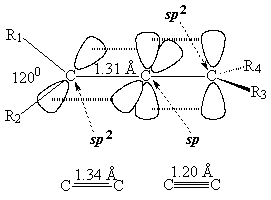
 El mayor caracter "s" de los orbitales híbridos del carbono central ocasionan que la distancia C-C sea un poco más corta que en un alqueno.
El mayor caracter "s" de los orbitales híbridos del carbono central ocasionan que la distancia C-C sea un poco más corta que en un alqueno. El 2,3-pentadieno tiene dos estructuras enantioméricas.
El 2,3-pentadieno tiene dos estructuras enantioméricas.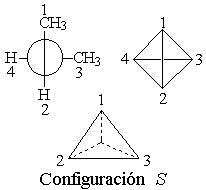
 La longitud del enlace central es intermedia entre la de uno simple y uno doble.
La longitud del enlace central es intermedia entre la de uno simple y uno doble. El solapamiento lateral de los cuatro orbitales atómicos "p"produce cuatro orbitales moleculares "pi". El orbital "pi1" deslocaliza la densidad electrónica a lo largo de los cuatro átomos implicados en un dieno conjugado. Sin embargo en el "pi2" no. Esto explica el carácter doble parcial del enlace central.
El solapamiento lateral de los cuatro orbitales atómicos "p"produce cuatro orbitales moleculares "pi". El orbital "pi1" deslocaliza la densidad electrónica a lo largo de los cuatro átomos implicados en un dieno conjugado. Sin embargo en el "pi2" no. Esto explica el carácter doble parcial del enlace central.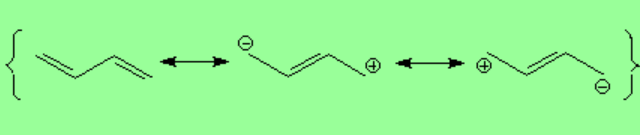
 Este giro es más costoso (6.7 kcal/mol) que en un alcano debido a que en el ET, con los planos de los dobles enlaces a 90º, no es posible el solapamiento del orbital "pi1".
Este giro es más costoso (6.7 kcal/mol) que en un alcano debido a que en el ET, con los planos de los dobles enlaces a 90º, no es posible el solapamiento del orbital "pi1".