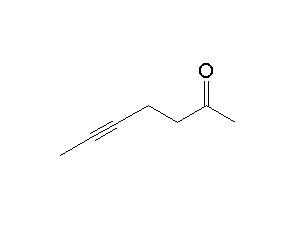
¿Cómo plantearías la preparación del alquino de la derecha?
PISTA: Utiliza la protección/desprotección del grupo C=O
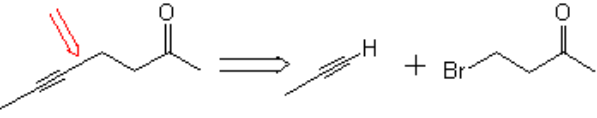
Retrosintéticamente hablando, el enlace estratégico que habría que formar es el indicado (flecha roja), aprovechando la acidez relativa del propino que, una vez desprotonado, podría alquilarse con el derivado halogenado apropiado:
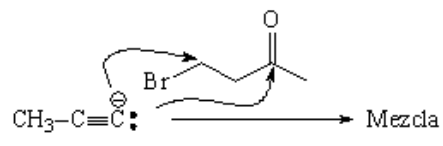
Pero la idea tiene un problema grave. ¿Adivinas cuál es?
El carbonilo de la cetona es un centro electrófilo que compite con el carbono halogenado.
La reacción dará una mezcla inoportuna de productos y, por tanto, será muy ineficiente.
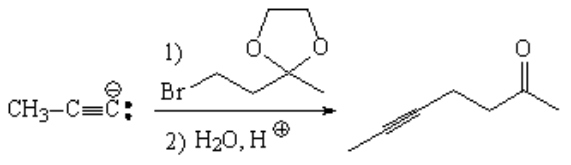
La solución es proteger el grupo carbonilo de la cetona con un acetal, antes de llevar a cabo la reacción de sustitución nucleófila del halógeno por el anión del alquino.
Después se recupera el carbonilo mediante hidrólisis ácida.
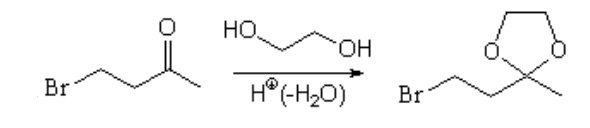
Pero, ¿cómo se hace el acetal?
Es muy común la utilización de etilenglicol como como protector de aldehídos y cetonas.
El etilenglicol lleva en sí mismo las "dos funciones alcohol" necesarias para formar un acetal cíclico muy estable.