CICLOADICIÓN DE DIELS - ALDER
La reacción de un dieno conjugado con una olefina da lugar a un ciclohexeno.
Es una reacción espectacular donde se forman dos enlaces "sigma" C-C a costa de dos enlaces "pi".
Los dobles enlaces C=C del dieno conjugado cooperan para reaccionar con la olefina como si fueran una "pinza".
Por ejemplo, el 1,3-pentadieno reacciona con el ácido propenoico para dar el ácido 2-metilciclohex-3-eno carboxílico
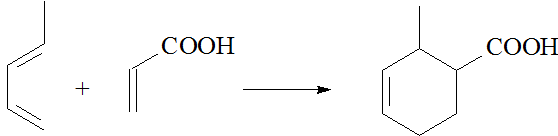
Esta reacción fue descubierta por los químicos orgánicos Diels y Alder, que consiguieron por ello el premio Nobel en 1950.
Otto P. H. Diels (1876-1954): Químico alemán, profesor de la Universidad de Kiel, con Kurt Alder es autor de la “síntesis diénica”, procedimiento de obtención de alquenos. Además de su interés teórico, este método ha permitido la síntesis de alcanfor, de la vitamina D y de la cortisona. Premio Nobel de Química compartido con Alder en 1950.
Kurt Alder (1902-1958): Químico alemán, profesor de la Universidad de Colonia. Alumno de Otto Diels, colaboró en los trabajos de éste; recibieron ambos conjuntamente el Premio Nobel de Química en 1950.
La reacción transcurre mediante un único ET en el que las nubes pi interaccionan. Se rompen tres enlaces pi y se forman dos sigma y uno pi nuevo
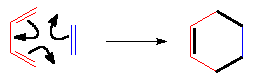 Se produce un ET en el que los electrones pi "circulan" para formar los nuevos enlaces (en negro). En los colores del ciclohexeno resultante descubrimos qué carbono aporta cada molécula reaccionante.
Se produce un ET en el que los electrones pi "circulan" para formar los nuevos enlaces (en negro). En los colores del ciclohexeno resultante descubrimos qué carbono aporta cada molécula reaccionante.
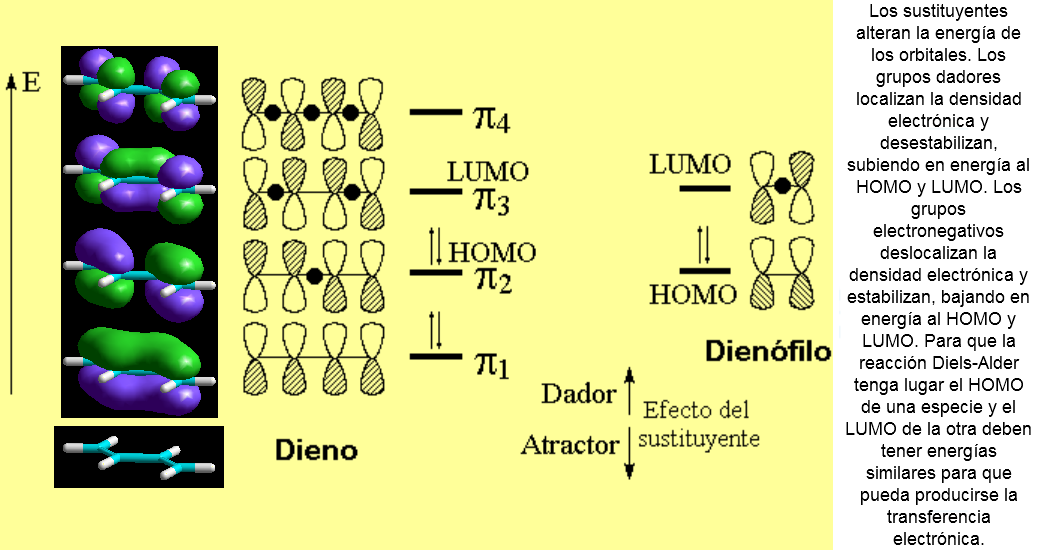
La interacción de las nubes pi en el ET puede entenderse fácilmente mediante un sencillo diagrama de orbitales moleculares
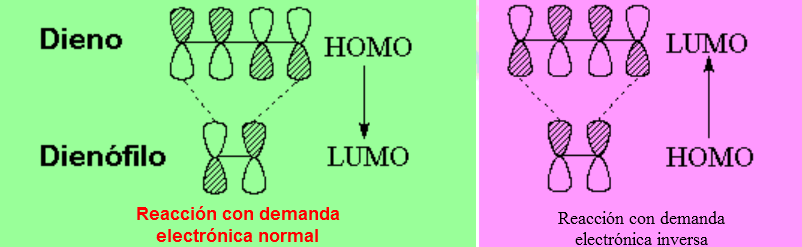
El orbital ocupado más alto (HOMO) de una especie ha de interaccionar con el orbital desocupado más bajo (LUMO) de la otra especie: "Nucleófilo ataca a electrófilo", como siempre.
Por tanto se pueden dar dos situaciones. Fíjate en que en ambas la simetría de los orbitales es la apropiada para que en el ET se dé una situación enlazante y se formen los dos enlaces sigma.
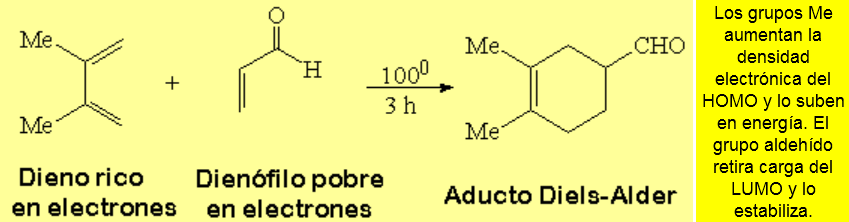
Generalmente el dieno actúa como la especie que aporta los electrones y el dienófilo es el que los recibe. A esta situación se le denomina demanda electrónica normal.
Por tanto, la reacción se favorece si en el dieno hay grupos dadores de electrones y en el dieno grupos electronegativos:
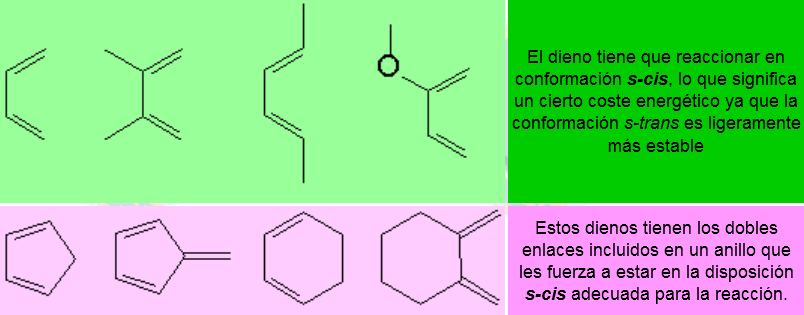
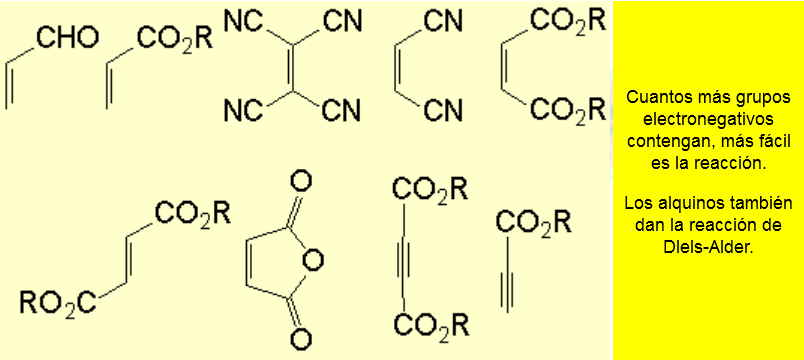
Entre los dienos más utilizados se encuentran:
Entre los dienófilos más usados podemos encontrar los siguientes:
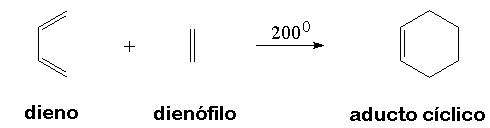
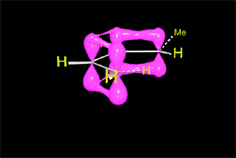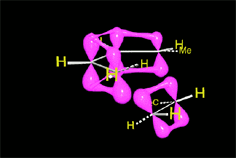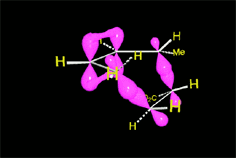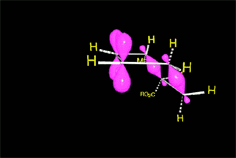
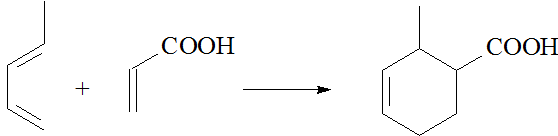


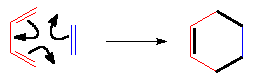 Se produce un ET en el que los electrones pi "circulan" para formar los nuevos enlaces (en negro). En los colores del ciclohexeno resultante descubrimos qué carbono aporta cada molécula reaccionante.
Se produce un ET en el que los electrones pi "circulan" para formar los nuevos enlaces (en negro). En los colores del ciclohexeno resultante descubrimos qué carbono aporta cada molécula reaccionante.